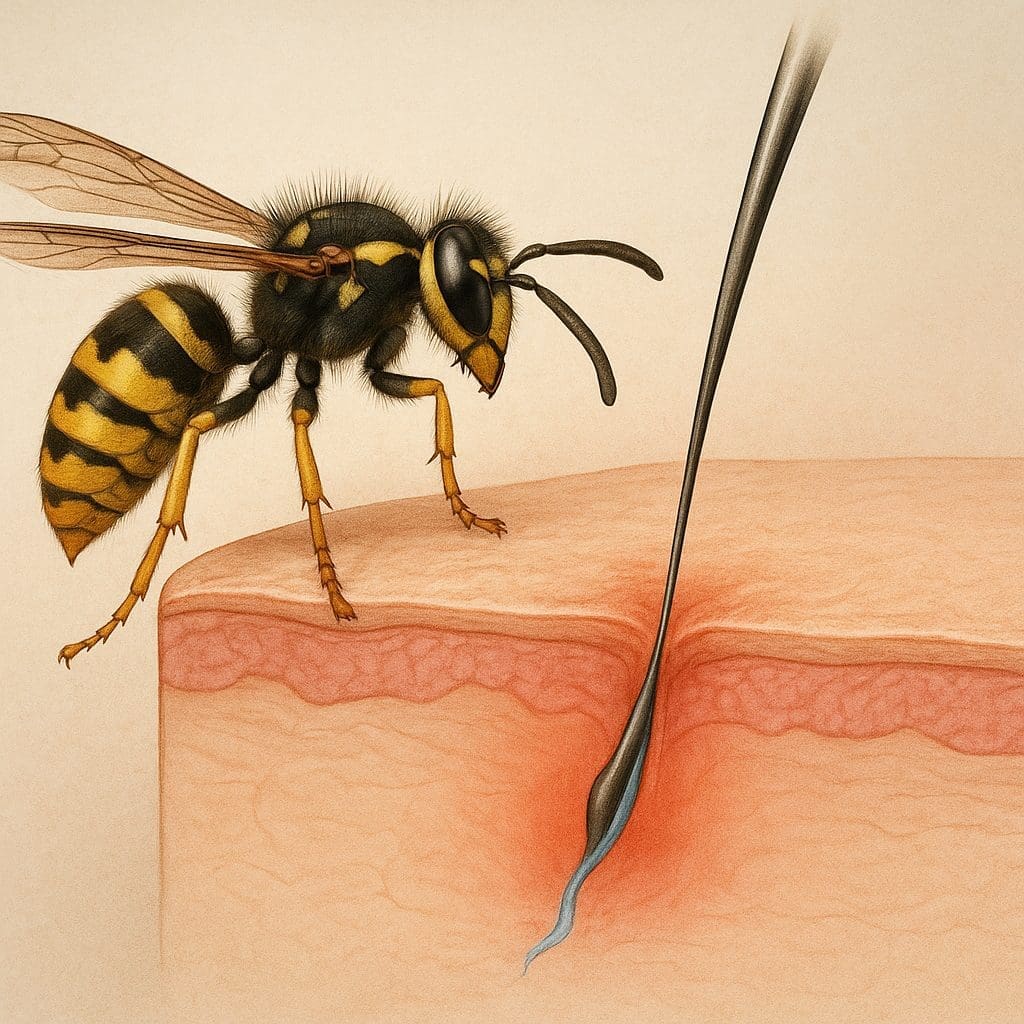
Poznanie działania jadu osy pozwala zrozumieć zarówno mechanizmy obronne tych owadów, jak i reakcje, jakie wywołuje w organizmach ludzi czy zwierząt. Badania nad tą złożoną mieszaniną biochemiczną przynoszą wnioski istotne nie tylko dla medycyny ratunkowej, ale również dla prac nad nowymi lekami czy technologiami inspirowanymi naturą.
Budowa i skład toksyny osy
Układ wydzielniczy osy składa się z gruczołu jadowego oraz kanalika prowadzącego do żądła. Wytwarzany w gruczole otej mieszaninie białek, peptydów i niskocząsteczkowych związków chemicznych nadaje jej różne właściwości biologiczne. Najważniejsze składniki to:
- Neurotoksyczny peptyd mastoparan – destabilizuje błony komórkowe i wywołuje napływ jonów wapnia.
- Fosfolipaza A2 – rozkłada fosfolipidy błon komórkowych, co prowadzi do uwolnienia kwasu arachidonowego i kaskady stanów zapalnych.
- Histamina i serotonina – powodują miejscową reakcję naczyniową, zaczerwienienie i obrzęk.
Właściwości toksyczne
Połączenie działania enzymów i mediatorów zapalnych sprawia, że jad osy może działać silniej niż jad pszczoły. Jego wieloskładnikowa natura oznacza, że wywołuje zarówno skutki miejscowe, jak i ogólnoustrojowe. Różnice między gatunkami os są znaczące: np. Vespula vulgaris ma nieco inny profil peptydów niż Polistes dominula.
Mechanizm działania jadu osy
Interakcja z układem nerwowym i układem odpornościowym przebiega wieloetapowo. Główne etapy to:
- Wstrzyknięcie jadu – podczas żądlenia osa wprowadza toksyny bezpośrednio do skóry lub śluzówki.
- Penetracja błon – mastoparan oraz fosfolipaza A2 uszkadzają komórki, powodując uwalnianie mediatorów zapalnych.
- Aktywacja komórek tucznych – wydzielanie histamina triggeruje miejscowe reakcje – zaczerwienienie, pieczenie, ból.
- Uwalnianie cytokin – odpowiedź immunologiczna przyciąga granulocyty i makrofagi, co może prowadzić do dalszego obrzęku.
- Efekt ogólnoustrojowy – przy większej ilości ukłuć toksyny wchodzą do krwiobiegu, zaburzając pracę mięśnia sercowego i układu oddechowego.
Wpływ na układ nerwowy
Dzięki zdolności wiązania się z receptorami jonotropowymi, niektóre peptydy jadu osy wykazują działanie neurotoksyczne. Blokują kanały sodowe i potasowe, co prowadzi do zakłócenia przewodnictwa nerwowego. Objawia się to drgawkami, zawrotami głowy, a w skrajnych przypadkach – porażeniem mięśni oddechowych.
Reakcje u ludzi i zwierząt
Różnorodność składników jadu sprawia, że reakcje po ukłuciu mogą mieć różny przebieg:
- Reakcja miejscowa – ból, zaczerwienienie, świąd, obrzęk trwające kilka godzin.
- Reakcja ogólnoustrojowa – nudności, wymioty, zawroty głowy.
- Alergiczny wstrząs anafilaktyczny – gwałtowne spadki ciśnienia, zaburzenia oddychania, mogące zagrażać życiu.
U osób uczulonych na jad osy kluczową rolę odgrywają przeciwciała IgE. Po przyłączeniu toksyn białka powierzchniowe komórek tucznych aktywują się i uwalniają mediatory, co uruchamia kaskadę anafilaktyczną. W organizmach zwierząt objawy bywają zbliżone, jednak często widoczne są dodatkowe objawy neurologiczne lub kardiologiczne.
Interwencja medyczna
Podstawowy protokół postępowania obejmuje:
- Usunięcie żądła – zapobiega dalszemu uwalnianiu jadu.
- Chłodzenie miejsca ukłucia – zmniejsza przekrwienie i puchnięcie.
- Podanie leków przeciwhistaminowych i kortykosteroidów – hamuje immunologiczna reakcję zapalną.
- Adrenalina w anafilaksji – kluczowe antidotum ratujące życie.
Zastosowania naukowe i medyczne
Choć jad osy jest groźny, jego składniki stają się inspiracją do opracowywania nowych terapii. Przykłady wykorzystania:
- Badania nad lekami przeciwnowotworowymi – peptydy cytolityczne selektywnie niszczą komórki nowotworowe.
- Rozwój środków przeciwbólowych – modulacja receptorów jonowych może prowadzić do nowych analgetyków.
- Zastosowanie w apiterapia i terapii komplementarnej – prowadzi się próby kontrolowanego wykorzystania małych dawek jadu do stymulacji układu odpornościowego.
- Inspiracja dla biomimetyka – synteza powierzchniowych biomateriałów o właściwościach przeciwbakteryjnych.
Przyszłe kierunki badań
Naukowcy koncentrują się na izolacji konkretnych peptydów i enzymów, by minimalizować efekt uboczny i maksymalizować terapeutyczne działanie. Nowoczesne techniki genetyczne i chemiczne umożliwiają modyfikację struktury toksyn, dzięki czemu tworzone są molekuły o lepszej biodostępności i mniejszej immunogenności.